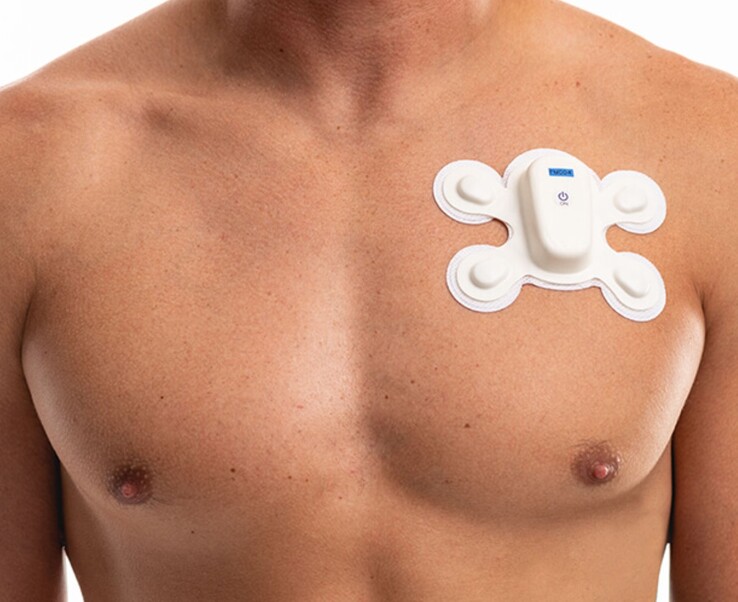
Bezprzewodowy biosensor do noszenia LifeSignals UbiqVue 2A otrzymał certyfikat EU MDR (European Union Medical Device Regulation), dzięki czemu może otrzymać znak CE i być używany w placówkach medycznych w całej UE.
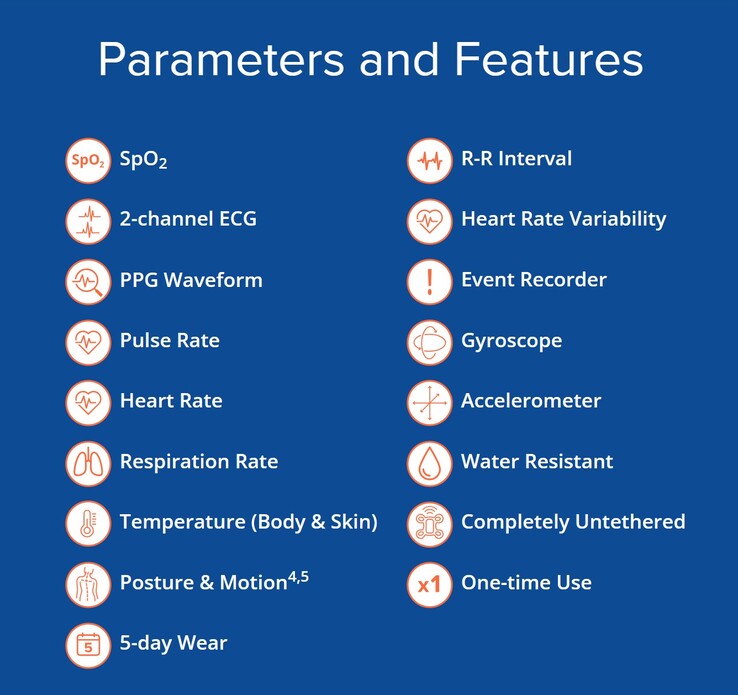
Urządzenie do noszenia ma wbudowane Wi-Fi 802.11b, Bluetooth 5.2 LE i łączność bezprzewodową MBAN. Pozwala to urządzeniu na ciągłe przekazywanie 12 parametrów zdrowotnych pacjenta wraz z danymi dotyczącymi upadków, ruchu i postawy lekarzom z daleka za pośrednictwem transferów danych w chmurze zgodnych z HIPAA i RODO. Pamięć wewnętrzna może przechowywać dane do 12 godzin, gdy komunikacja danych nie jest dostępna. Wbudowana bateria litowo-manganowa (LiMnO2) zasila urządzenie jednorazowego użytku do pięciu dni.
UbiqVue 2A znacznie zmniejsza liczbę wymaganych urządzeń, upraszczając życie pracowników służby zdrowia i pacjentów. Ważne mierzone parametry obejmują nasycenie krwi pacjenta tlenem, tętno, częstość oddechów i temperaturę. Urządzenie posiada również dwukanałowy elektrokardiogram, aby zapewnić lepszy wgląd w aktualny stan zdrowia pacjentów powracających do zdrowia. Czytelnicy z chorobami serca mogą monitorować siebie za pomocą smartfona i KardiaMobile Personal EKG Monitor(sprzedawany tutaj na Amazon).
Wbudowany żyroskop i akcelerometr zapewniają ciągłe monitorowanie pozycji i ruchu pacjenta, ostrzegając pracowników służby zdrowia o problemach, takich jak nieoczekiwany upadek. Biosensor ma wymiary 4,6 x 3,6 x 0,7 cala (116 x 91 x 17 mm), waży 1,23 uncji (35 g) i posiada stopień ochrony IP24 przed rozpryskami wody.
4 grudnia 2024 r
System oparty na chmurze, wyposażony w nadający się do noszenia biosensor ze SpO2 na klatce piersiowej, umożliwia aktywne monitorowanie pacjenta w warunkach szpitalnych i pozaszpitalnych
Zastępuje czasochłonną ręczną kontrolę wyrywkową ciągłym, aktywnym monitorowaniem pacjenta w czasie zbliżonym do rzeczywistego
Internetowy system wyświetla w sposób ciągły wiele danych fizjologicznych pacjenta, z alarmami wizualnymi i powiadomieniami o alertach w celu usprawnienia opieki nad pacjentem
Opracowany w celu wspierania skalowalnego zarządzania zdrowiem populacji
Po zatwierdzeniu przez FDA 510(k)
Milpitas, Kalifornia, USA. 5 grudnia 2024 r: LifeSignals, Inc. ogłosiła dziś, że system wieloparametrowy UbiqVue 2A otrzymał certyfikat EU MDR, co stanowi kolejny znaczący kamień milowy we wdrażaniu ciągłego bezprzewodowego monitorowania pacjentów w celu zarządzania zdrowiem populacji po uzyskaniu zgody FDA 510(k) w zeszłym miesiącu. UbiqVue 2A został tym samym zatwierdzony i oznaczony znakiem CE zgodnie z rozporządzeniem UE w sprawie wyrobów medycznych, które zapewnia bezpieczeństwo i wydajność sprzętu medycznego. Jest to szczególnie istotne, ponieważ system wieloparametrowy UbiqVue 2A został zaprojektowany do wdrożenia w warunkach domowych, a także szpitalnych w celu ciągłego monitorowania danych fizjologicznych pacjentów, zastępując pracochłonne i potencjalnie niedokładne kontrole wyrywkowe
Centralnym elementem systemu jest biosensor UbiqVue 2A, jednorazowe, uniwersalne urządzenie do noszenia, które umożliwia ciągłe zbieranie SpO2** z klatki piersiowej, wraz z innymi danymi biologicznymi, w celu wygenerowania łącznie dwunastu monitorowanych parametrów, w tym dwukanałowego EKG, częstości tętna, PPG, częstości oddechów, temperatury ciała i ruchu. Zaszyfrowane dane są bezpiecznie przesyłane w czasie zbliżonym do rzeczywistego z biosensora za pośrednictwem aplikacji przekaźnikowej lub punktu dostępu do bezpiecznego systemu opartego na chmurze, gdzie są dalej przetwarzane. Pracownicy służby zdrowia i dostawcy opieki mogą uzyskać dostęp do ciągłych parametrów życiowych za pośrednictwem portalu internetowego UbiqVue i otrzymywać powiadomienia o alertach.
"Certyfikat MDR UE klasy IIb, zwykle przyznawany urządzeniom przeznaczonym do ciągłego monitorowania istotnych parametrów fizjologicznych w anestezjologii, intensywnej terapii lub opiece w nagłych wypadkach, potwierdza nasze zaangażowanie w dostarczanie funkcji równoważnych z przyłóżkowym monitorem pacjenta za pośrednictwem przystępnego cenowo, jednorazowego biosensora" - powiedział Surendar Magar, współzałożyciel i dyrektor generalny. "Zapewniając niezbędne zezwolenia regulacyjne w różnych regionach geograficznych i tworząc globalne partnerstwa z producentami OEM, dostawcami usług i dystrybutorami, dążymy do przekształcenia opieki zdrowotnej na dużą skalę"
Oczekuje się, że system UbiqVue odegra istotną rolę w rozwoju zarówno indywidualnej opieki nad pacjentem, jak i szerszych strategii zdrowotnych populacji, wzmacniając misję LifeSignals polegającą na dostarczaniu innowacyjnych, bezprzewodowych rozwiązań dla systemów opieki zdrowotnej na całym świecie. Więcej informacji znajdą Państwo na stronie: www.lifesignals.com/ubiqvue-multiparameter/
** Opatentowana technologia spektralnego pomiaru SpO2 w świetle białym licencjonowana od BioIntelliSense, Inc. Firma LifeSignals, Inc. we współpracy z BioIntelliSense opracowała projekt na poziomie produktu i ulepszenia technologii przetwarzania umożliwiające niezawodne, ciągłe monitorowanie SpO2 i dokładne działanie we wszystkich odcieniach skóry w biosensorze noszonym na klatce piersiowej.
ODKRYJ UBIQVUE
O LifeSignals Inc.
LifeSignals dostarcza skalowalne rozwiązania do monitorowania pacjentów dla zdrowia populacji. Rewolucjonizując sposób, w jaki istotne dane biomedyczne - sygnały życia - są przechwytywane i dostarczane, umożliwiamy dostawcom opieki zdrowotnej poprawę wyników. Nasz bezprzewodowy system monitorowania pacjentów UbiqVue obejmuje jednorazowe, wieloparametrowe biosensory do noszenia, w pełni napędzane przez zastrzeżoną technologię krzemową system-on-chip. To gotowe do wdrożenia rozwiązanie zapewnia płynne, dokładne i ekonomiczne monitorowanie pacjentów w warunkach klinicznych i środowiskowych. Aby dowiedzieć się więcej, prosimy odwiedzić stronę www.lifesignals.com.
Informacje na temat europejskiego rozporządzenia w sprawie wyrobów medycznych (MDR)
Rozporządzenie UE w sprawie wyrobów medycznych (MDR) to zaktualizowana wersja dyrektywy UE w sprawie wyrobów medycznych (MDD), która zastąpiła ją w 2021 roku. Rozporządzenie MDR jest bardziej rygorystyczne, kompleksowe i świadome technologii w porównaniu z dyrektywą MDD, która koncentruje się na całym cyklu życia produktu, w tym na rozwoju, testowaniu, produkcji i długotrwałym użytkowaniu.